Aujourd'hui on considère les produits ménagers comme des produits inoffensifs car très usuels et donc banalisés. Mais ils demeurent, pour la plupart, des produits chimiques de synthèse dont la stabilité n'est pas toujours garantie.
Mélanger des produits non stables avec d'autres éléments chimiques est dangereux. La négligence ou tout simplement l'ignorance de certaines personnes peut être la cause de grands dommages allant jusqu'à la mort de certaines personnes.
Quels sont les produits dont on doit craindre le mélange et quels phénomènes sont responsables de ces réactions si dangereuses ?
Nous exprimerons ici la nature, les causes et les conséquences de ces mélanges dangereux par le biais d'une démarche en plusieurs étapes.
Nous débuterons par la recherche d'un spécialiste du sujet qui, lors d'une interview filmée, nous indiquera les mélanges les plus fréquents, dangereux, inattendus… De cette entrevue, nous tirerons un ou plusieurs mélanges dont nous étudierons plus précisément les réactifs, les produits mais surtout les conséquences modélisées.
C'est donc naturellement que le blog s'impose comme support : il permet de facilement exposer nos vidéos, et marque le rythme des étapes de la démarche.
—Interview
Cette interview a été effectuée grâce aux différentes informations que nous avons collectées auprès de spécialistes de differentes associations (Centre Anti-Poison de Paris, de Marseille).
Avec le rassemblement de ces informations, nous avons écrit le scénario d’un « docu-fiction » que nous avons tourné avec la gracieuse participation de Mme Kuhn-Carrega qui joue le rôle de la spécialiste dans ce document.
Nous considérons désormais cette interview comme point de départ de notre démarche, et donc comme la réelle interview que nous étions censés réaliser.
De cette interview, nous avons tiré les informations suivantes :
L’eau de Javel est un produit très fréquemment (voire le plus fréquemment) mis en cause dans les mélanges dangereux de produits du quotidien : son mélange avec des acides ou avec des produits ammoniaqués est responsable de nombreux accidents ménagers, cette réaction provoquant le dégagement de gaz qui entraînent des intoxications pouvant aboutir à la mort en cas d’exposition prolongée à ces gaz.
Le DCCNa (pastille ou granulé de Javel) en présence d’humidité, d’une petite quantité d’eau ou de sels hydratés susceptibles de libérer de l’eau se décompose ; il peut alors se former du chlore et du trichlorure d’azote susceptible de donner lieu à des explosions spontanées.
Avec des dérivés azotés tels que l’ammoniac et ses sels, les amines, l’urée, le chlore peut former du trichlorure d’azote explosible.
Par la suite nous étudierons plus précisément la composition de l’eau de Javel et les mélanges abordés lors de l’interview.
Dans un premier temps, nous aborderons les mélanges toxiques - eau de Javel + acide et eau de Javel + ammoniac -, puis les mélanges explosifs - DCCNa + humidité et Chlore + azote.
—L'Eau de Javel

L'hypochlorite de sodium, solide blanc, est un composé chimique de formule NaClO, fabriqué à partir de chlore Cl et de soude NaOH.
Sa mise en solution aqueuse donne l'eau de Javel (ou Javel), puissant oxydant.
Commercialisée sous forme liquide (bouteilles, berlingots) ou sous forme solide (pastilles), l'eau de Javel sert principalement dans les tâches ménagères comme désinfectant pour locaux, sanitaires, éviers, et le traitement de l'eau potable, ou comme décolorant. La concentration d'hypochlorite de sodium dans la solution d'eau de Javel varie selon la dilution.
L'hypochlorite de sodium NaClO est un sel de sodium de l'acide hypochloreux HClO. En solution, l'hypochlorite de sodium NaClO se décompose en ions sodium Na+ et hypochlorite ClO-.
NaClO -> Na+ + ClO-.
HClO est un acide dont la base conjuguée est l'ion hypochlorite ClO-. L'équilibre acido-basique du couple HClO / ClO- s'écrit :
HClO = H+ + ClO-
La composition de l'eau de Javel dépend du pH, selon les deux équilibres chimiques suivants :
HClO = H+ + ClO-
HClO + H+ + Cl- = Cl2 + H2O
L'eau de Javel est nocive pour la santé (produit toxique et corrosif) et pour l'environnement (dégradation de la faune et de la flore). Étant un produit basique, il faut se méfier des mélanges : en combinaison avec certains produits, une réaction dangereuse s'effectue.
—Mélanges avec l’Eau de Javel

L’hypochlorite de sodium, principe actif de l’eau de Javel, est peu stable. De ce fait, son mélange avec un acide déclenche le dégagement de chlore gazeux, pouvant provoquer une irritation bronchique, voire un œdème aigu pulmonaire d’apparition parfois retardée. Le mélange avec de l’ammoniaque ou tout autre produit ammoniaqué provoque la formation de chloramines, également irritantes au niveau respiratoire.
Eau de Javel + Acide :
Lorque l’eau de Javel entre en contact avec un acide qui va libérer des ions H+, la réaction suivante se produit :
HClO + H+ + Cl- → Cl2 + H2O
Il se produit un dégagement de dichlore Cl2 qui est un gaz très toxique. Il ne faut donc jamais mélanger l’eau de Javel avec des acides que l’on trouve, par exemple, dans des produits détartrants ou dans l’urine.
Pourtant, cet avertissement, bien que clairement indiqué sur les bidons, bouteilles, berlingots d’eau de Javel, ne semble pas suffire :
En effet, de nombreuses personnes pensent pouvoir augmenter l’efficacité des propriétés désinfectantes de l’eau de Javel, et réalisent des recettes « maison » :
Ainsi, le mélange avec des acides arrive fréquemment, acides souvent achetés spécialement pour cela, particulièrement l'acide chlorhydrique.

Eau de Javel + Ammoniac :
Lorsqu'ils sont mis en présence, l'acide hypochloreux HClO et l'ammoniac NH3 produisent des chloramines selon les réactions suivantes :
NH3 + HOCl → NH2Cl + H2O
ammoniac + acide hypochloreux → monochloramine + eau
NH2Cl + HOCl → NHCl2 + H2O
monochloramine + acide hypochloreux → dichloramine + eau
NHCl2 + HOCl → NCl3 + H2O
dichloramine + acide hypochloreux → trichloramine + eau
Les chloramines gazeuses sont très irritantes. C'est pour cela qu'il ne faut pas mélanger l'eau de Javel avec de l'ammoniaque.
C’est la même réaction qui a lieu lorsqu’un nageur urine dans l’eau d’une piscine désinfectée au chlore. L’urée contenue dans l’urine est un produit azoté. Il va donc se former des chloramines irritantes pour les muqueuses et les yeux.
Nous traiterons de cet exemple dans l'article suivant

—Exemple de Dégagement Gazeux Nocifs

C’est la même réaction qui a lieu dans les piscines :
Le chlore produit par la décomposition du DCCNa en contact avec l’eau de la piscine réagit avec l’urée et la sueur des nageurs, produits azotés, pour provoquer un dégagement de chloramines et de trichlorure d’azote (voir chapitre suivant). Ces chloramines entraînent alors l’irritation des nageurs.
Ainsi, 20 à 30% des nageurs de compétition ont développé de l’asthme après avoir respiré quotidiennement ces vapeurs créées au contact du chlore, de l’urine et de la sueur dans l’eau des piscines.
Ces incidents entraînant des émanations de chlore gazeux surviennent principalement dans les piscines municipales et les centres culturels (47%), suivis par les écoles (35%) et des hôtels (18%). Les principaux risques de ces incidents en piscines publiques (et privées) sont associés aux manipulations inadéquates des produits chimiques et, dans une moindre mesure, aux défaillances techniques du matériel de traitement de l’eau.
Ces évènements sont non négligeables d’un point de vue de santé publique puisque, selon les données recensées, des baigneurs ont été intoxiqués dans 70% des incidents et hospitalisés dans 50% des cas.
—Variables touchées
Les recherches effectuées au CAPP (Centre Anti-Poison de Paris) nous ont permis de trouver des données récoltées suite à une étude au CAPM (Centre Anti-Poison de Marseille). En comparant ces données avec la ligne « Suffocation » (dans laquelle le mélange Javel-Acide est compris) des données d’une association britannique, RoSPA (Royal Society for the Prevention of Accidents), récoltées au cours des années 2000-2002, nous avons trouvé les résultats suivants :


On remarque que les données du CAPM et celles de la RoSPA sont assez semblables, surtout au niveau de l’âge des personnes atteintes par ces suffocations. Ainsi, cela nous a permis de généraliser les données du CAPM, et donc d’établir la courbe suivante grâce aux données de la RoSPA : représenté en abscisse est l’âge des personnes atteintes par le mélange, tandis que l’ordonnée représente le nombre de personnes atteintes par ce même mélange.
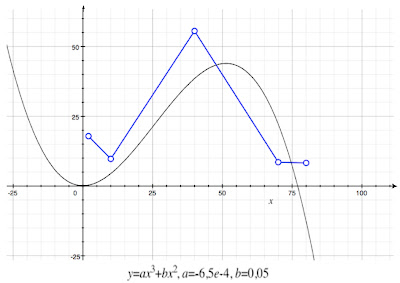
Il apparaît tout de suite très clairement que les personnes les plus touchées par ces suffocations, donc par le mélange Javel+acide, sont les adultes allant de 25 à 50 ans : on observe un pic très prononcé à ce niveau.
Par interpolation (création de fonction usuelle se rapprochant le plus de la fonction trouvée), on trouve la courbe suivante d’équation y = (-6,5e-4)x^3+0,05x^2.
Étude de la courbe d’interpolation d’équation y = (-6,5e-4)x^3+0,05x^2 :
Soit f la fonction suivante : f(x) = (-6,5e-4)x^3+0,05x^2.
f étant un polynôme, elle est définie sur ]-∞ ; +∞[ et donc dérivable sur ce même intervalle.
Calcul de la dérivée :
f’(x) = 3(-6,5e-4)x^2 + 2(0,05x) = (-1,95e-3)x^2 + 0,1x
f’ est une fonction polynôme du second degré :
∆ = (0,1)^2 – 4(-1,95e-3)(0) = 0,1^2 = 0,01 ∆ > 0
Il y a donc deux racines :
A = (-0,1-√∆)/[(2)(-1,95e-3)] = (-0,1-0,1)/[(2)( -1,95e-3)] = (-0,2)/[(2)( -1,95e-3)]
A = (-0,1)/( -1,95e-3) = 1/(1,95e-2)
B = (-0,1+√∆)/[(2)( -1,95e-3)] = (-0,1+0,1)/[(2)( -1,95e-3)] = 0
On peut donc dresser le tableau de variations suivant :
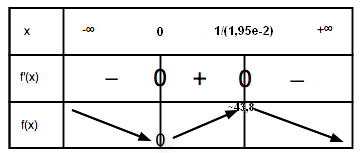
Nous nous intéresserons particulièrement aux variations de la courbe sur l’intervalle [0 ; 120], étant donné que l’âge des personnes vivant sur la Terre est compris dans cet intervalle (sauf très rares cas).
Déjà sur la courbe nous pouvons facilement discerner un maximum se situant aux alentours d’une cinquantaine d’années, représentant 45% des personnes atteintes par les accidents de suffocation.
Le tableau de variations nous permet maintenant de préciser ce maximum qui se situe au point d’abscisse 1/(1,95e-2) ≈ 51,3.
Le maximum en ce point est :
f(1/(1,95e-2)) ≈ 43,8.
Ainsi pouvons-nous affirmer que la plupart des personnes (presque la moitié) atteintes par des suffocations est âgée d’une cinquantaine d’année.
Cet accident survient donc le plus fréquemment chez les adultes.
Ces résultats étaient à prévoir : ce sont bien les adultes qui manient les produits ménagers courants comme l’eau de Javel et les acides, et ce sont donc bien eux les plus exposés à ce genre d’accident, malgré la prévention et la sécurité exigée par les commerçants. Espérons que ce nombre aura tendance à diminuer avec le temps.


On remarque que les données du CAPM et celles de la RoSPA sont assez semblables, surtout au niveau de l’âge des personnes atteintes par ces suffocations. Ainsi, cela nous a permis de généraliser les données du CAPM, et donc d’établir la courbe suivante grâce aux données de la RoSPA : représenté en abscisse est l’âge des personnes atteintes par le mélange, tandis que l’ordonnée représente le nombre de personnes atteintes par ce même mélange.

Il apparaît tout de suite très clairement que les personnes les plus touchées par ces suffocations, donc par le mélange Javel+acide, sont les adultes allant de 25 à 50 ans : on observe un pic très prononcé à ce niveau.
Par interpolation (création de fonction usuelle se rapprochant le plus de la fonction trouvée), on trouve la courbe suivante d’équation y = (-6,5e-4)x^3+0,05x^2.
Étude de la courbe d’interpolation d’équation y = (-6,5e-4)x^3+0,05x^2 :
Soit f la fonction suivante : f(x) = (-6,5e-4)x^3+0,05x^2.
f étant un polynôme, elle est définie sur ]-∞ ; +∞[ et donc dérivable sur ce même intervalle.
Calcul de la dérivée :
f’(x) = 3(-6,5e-4)x^2 + 2(0,05x) = (-1,95e-3)x^2 + 0,1x
f’ est une fonction polynôme du second degré :
∆ = (0,1)^2 – 4(-1,95e-3)(0) = 0,1^2 = 0,01 ∆ > 0
Il y a donc deux racines :
A = (-0,1-√∆)/[(2)(-1,95e-3)] = (-0,1-0,1)/[(2)( -1,95e-3)] = (-0,2)/[(2)( -1,95e-3)]
A = (-0,1)/( -1,95e-3) = 1/(1,95e-2)
B = (-0,1+√∆)/[(2)( -1,95e-3)] = (-0,1+0,1)/[(2)( -1,95e-3)] = 0
On peut donc dresser le tableau de variations suivant :

Nous nous intéresserons particulièrement aux variations de la courbe sur l’intervalle [0 ; 120], étant donné que l’âge des personnes vivant sur la Terre est compris dans cet intervalle (sauf très rares cas).
Déjà sur la courbe nous pouvons facilement discerner un maximum se situant aux alentours d’une cinquantaine d’années, représentant 45% des personnes atteintes par les accidents de suffocation.
Le tableau de variations nous permet maintenant de préciser ce maximum qui se situe au point d’abscisse 1/(1,95e-2) ≈ 51,3.
Le maximum en ce point est :
f(1/(1,95e-2)) ≈ 43,8.
Ainsi pouvons-nous affirmer que la plupart des personnes (presque la moitié) atteintes par des suffocations est âgée d’une cinquantaine d’année.
Cet accident survient donc le plus fréquemment chez les adultes.
Ces résultats étaient à prévoir : ce sont bien les adultes qui manient les produits ménagers courants comme l’eau de Javel et les acides, et ce sont donc bien eux les plus exposés à ce genre d’accident, malgré la prévention et la sécurité exigée par les commerçants. Espérons que ce nombre aura tendance à diminuer avec le temps.
—Piscines : explosions dues aux mélanges
Certains produits chlorés d’usage courant peuvent, lors de leur mélange accidentel (ou volontaire) ou de leur humidification, libérer dans l’atmosphère du trichlorure d’azote (NCl3) en quantité suffisante pour déclencher un incendie ou une explosion. Ces produits, notamment autorisés pour la désinfection des piscines, sont à base :
— d’acide trichloroisocyanurique (ATCC)
— de dichloroisocyanurate de sodium (DCCNa) ou de potassium (DCCK).
Ces produits généralement commercialisés sous forme de pastilles ou de granulés peuvent être des comburants puissants. Ils comportent toutefois un certain nombre d’avantages par rapport aux autres sources de chlore (telle que l’eau de Javel) au nombre desquels une bonne stabilité chimique au stockage, une présentation solide et concentrée, une résistance aux ultraviolets et de meilleures conditions de sécurité et d’emploi.
Le risque chimique présenté par ces substances est principalement dû à une incompatibilité avec les dérivés azotés (ammoniac et ses sels, urée…) et les hypochlorites de sodium, potassium ou calcium. En effet, la mise en contact de ces produits en présence d’humidité avec des hypochlorites de calcium ou de sodium (eau de Javel) ou des dérivés azotés entraîne le dégagement de trichlorure d’azote, une substance qui s’enflamme spontanément du fait de sa grande instabilité chimique.
Ces réactions peuvent être représentées les équations chimiques suivantes :
Réaction du dichloro-isocyanurate de sodium et de l’eau :
DCCNa + H2O --> Cl + NCl3 (formule simplifiée)
Réaction du dichloro-isocyanurate de sodium et de l'hypochlorite de calcium :
DCCNa + CA(OCl)2 --> NCl3 (formule simplifiée)
La négligence de certaines personnes s’occupant de l’entretien de piscines à ainsi causé de nombreux dégâts, souvent plus matériaux que corporaux : après l’entretien des piscines, il est arrivé que les agents d'entretien n’aient pas fermé hermétiquement les produits, ceci entraînant leur humidification, et donc le dégagement de trichlorure d’azote, susceptible de donner lieu à des explosions spontanées.
De plus, le mélange de plusieurs désinfectants de piscine peut aussi donner naissance à un dégagement de trichlorure d’azote.
L’hypochlorite de calcium restant dans une bassine mal nettoyée peut ainsi réagir avec l’hypochlorite de sodium introduit afin de préparer une solution de chloration, ceci provoquant le dégagement des trichlorures, et donc le déclenchement d’un incendie ou d’une explosion spontanée.
Il faut donc bien lire les précautions indiquées sur les emballages, et prendre les mesures de sécurité préconisées lors de l’utilisation de produits désinfectants tels que le DCCNa, afin de ne pas provoquer des accidents stupides qui auraient pu être évités (voir exemple suivant).
—Video Urine + Javel
Vidéo Javel + urine
Vidéo envoyée par arielou
En réalité, ce n’est pas l’eau de Javel seulement qui provoque cette réaction d’explosion, mais tous les désinfectants à base de dichloro-isocyanurate de sodium (DCCNa), généralement présentés sous la forme de pastilles ou granulés. Au contact de l’eau, ce produit (DCCNa) se décompose pour former du chlore. Ce traitement désinfectant vise à détruire les bactéries et autres corps (algues, champignons…) susceptibles de se développer en milieu aquatique. Les matières azotées dissoutes dans l’eau (notamment la sueur et l’urine) se combinent avec le chlore présent pour former des chloramines et notamment du trichlorure d’azote, substance qui s’enflamme ou explose spontanément du fait de sa grande instabilité chimique.

—Conclusion
Les mélanges de produits anodins (ou du moins que nous sommes habitués à manipuler tous les jours) sont souvent dangereux : ils peuvent provoquer des dégagements de gaz nocifs pouvant provoquer d'importantes explosions, de graves infirmités ou même la mort. Ces mélanges sont parfois utilisés dans le but d'améliorer les effets d'un produit, mais aussi, ce qui se révèle plus dangereux car imprévisible, il se peut "qu'ils s'effectuent d'eux-même" (tout simplement pastille de Javel + eau : un conteneur mal refermé placé dans une pièce humide ou à côté d'une voie d'eau peut provoquer une explosion). Or, comment prévenir ces accidents et beaucoup d'autres ? Malheureusement, il semblerait que ceux-ci continueront à se produire, non pas tous les jours mais en nombre non négligeable, car les réactifs de ces mélanges sont utilisés quotidiennement, dans presque tous les endroits que nous côtoyons (écoles, appartements, piscines, bureau...), et ce, tous les jours.
—Sources
Sites internet :
•Site du Centre Anti Poison
•Article sur l'eau de Javel et ses réactions
•Exemple sur dégagement de chloramines dans les piscines
•Article sur l'eau de Javel
•Prévention sur la javel "À la maison"
•Statistiques nationales en UK
•Article sur l'explosion dans l'entretien des piscines
Documents du Centre de Documentation du CAPP :
Risque d'incendie et d'explosion. Produits pour piscines :
attention aux mélanges incompatibles.
RICHEZ Jean-Paul
actu/risque chimique, TRAVAIL ET SECURITE, 2002, n° 617, p. 13-15 - Périodique]
Attention aux mélanges avec l'eau de Javel
DE HARO Luc ; SOURDET Béatrice ; VALLI Marc
REVUE DU PRACTICIEN MEDECINE GENERALE, 2001, vol. 15, n° 533, p. 687-688 [RP2 - Périodique]
•Site du Centre Anti Poison
•Article sur l'eau de Javel et ses réactions
•Exemple sur dégagement de chloramines dans les piscines
•Article sur l'eau de Javel
•Prévention sur la javel "À la maison"
•Statistiques nationales en UK
•Article sur l'explosion dans l'entretien des piscines
Documents du Centre de Documentation du CAPP :
Risque d'incendie et d'explosion. Produits pour piscines :
attention aux mélanges incompatibles.
RICHEZ Jean-Paul
actu/risque chimique, TRAVAIL ET SECURITE, 2002, n° 617, p. 13-15 - Périodique]
Attention aux mélanges avec l'eau de Javel
DE HARO Luc ; SOURDET Béatrice ; VALLI Marc
REVUE DU PRACTICIEN MEDECINE GENERALE, 2001, vol. 15, n° 533, p. 687-688 [RP2 - Périodique]
—Syntheses Individuelles
Ariel CLAUDET :
Dans un premier temps, je fus très vite emballé par l’idée d’un TPE. Déjà l’année dernière, j’étais enthousiaste à l’idée de ce travail collectif. Tout d’abord, lors de la recherche d’un sujet, l’idée m’est venue d’utiliser ce qui m’avait été présenté comme une légende urbaine : le mélange Bailey’s et Schweppes, le mélange des deux breuvages produit un ciment très solide en quelques secondes. C’est lors des premières recherches autour du mélange des deux boissons que les complications débutèrent et que nous fûmes tous calmés dans nos ardeurs de chercheurs en herbe.
Nous décidâmes alors de nous généraliser. L’idée de mélange dangereux ou avec une expérience impressionnante à réaliser nous plaisant, nous nous sommes donc dirigés vers les mélanges de produits ménagers dangereux.
Mais lesquels choisir ? Nous avons donc décidé de laisser un spécialiste nous guider, c’est là que le concept de démarche naquit : un spécialiste nous indiquerait quelques mélanges, soit les plus dangereux, soit les plus fréquents ; nous en réaliserions les expériences puis les étudieraient. Mais c’est là où ce sont enchaînées les grosses complications. Nous avons été confrontés à un grand nombre de personnes désagréables qui ne voulaient pas nous aider par simple solidarité, ou bien étaient bloquées par la confidentialité (les données brutes des hôpitaux). Exceptée la documentaliste du Centre Anti-Poison de Paris qui nous a été d’une grande aide ; sans sa disponibilité, nous serions restés bloqués encore longtemps ou aurions changé de sujet.
Mattéo eut donc la merveilleuse idée du documentaire-fiction qui nous permettait d’intégrer toutes les documentations que nous pourrions obtenir pour nous faire diriger fictivement vers les mélanges qui nous arrangeaient le plus.
Nous prîmes une voie alternative. Par le biais de ce blog, nous avons pu intégrer notre touche personnelle aux recherches. C’est là un aspect que j’ai tout particulièrement apprécié dans cette démarche. Nous avons combiné nos talents : Mattéo à la caméra, Félix pour l’aspect compréhension du jargon de physique et moi-même autour de l’aspect technique (le blog) et dans l’organisation de la construction du travail, et nous tous quant aux recherches et à la rédaction des articles.
Pour ce qui est de l’aspect travail, étant habitué aux exposés et diverses présentations classiques, je ne m’attendais pas à la nécessité d’un tel approfondissement et à la somme de travail conséquente.
Ce devoir m’aura éclairci quant à la somme et le type de travail à fournir après le baccalauréat, c’est un travail où l’abstrait est banni, la spécialisation est de plus en plus précise et la connaissance plus dirigée, mais beaucoup plus poussée.
Ce fut un plaisir de réaliser ce TPE. Je me serais révélé un esprit collectif prononcé et, surtout, me serais épanoui lors de ce travail bien concret dans un cycle où les programmes conçus sont abstraits.
Félix CHEYSSON :
Au début de l’année, lorsqu’on m’annonçait qu’on devrait faire un TPE, je me suis questionné sur ce travail, bien que mon grand frère m’en avait déjà parlé. Le TPE était une nouveauté pour moi : je n’avais encore jamais effectué un travail très approfondi sur un domaine particulier. Ainsi, en compagnie de bons amis, nous avons cherché un sujet.
L’idée nous est d’abord venue avec le mélange Schweppes-Bailey’s, « boisson » qui se solidifie lors de la mise en contact des deux produits. Nous pensions que l’ingestion accidentelle (ou volontaire) de ce cocktail pouvait entraîner la solidification du mélange dans l’estomac, et donc la mort, si ingestion de trop grande quantité. Ainsi nous est venue l’idée de notre TPE : mélanges de produits anodins pouvant entraîner de graves accidents.
Nous décidâmes alors d’une démarche : trouver un spécialiste des accidents fréquents survenant à la suite d’un mélange de deux produits du quotidien, faire une interview filmée, et tirer de cet entretien le ou les mélanges compatibles à notre TPE que nous pourrions exploiter. Nous fîmes donc de nombreuses recherches, afin de trouver l’homme qui nous éclairerait. Mais elles furent infructueuses : aucun hôpital ne voulait nous accorder une entrevue. Heureusement, la découverte du Centre Anti-Poison nous redonna espoir, bien que l’entretien avec un spécialiste ne soit pas envisageable.
Nous nous lançâmes donc dans une série de recherches, afin de trouver le mélange à étudier. Un produit attira particulièrement notre attention : l’eau de Javel. De nombreux accidents étaient survenus à cause de mélanges dans lequel ce produit intervenait. C’est donc à partir de ce produit que nous construisîmes notre TPE, dont voilà le résultat un peu plus haut.
Cette démarche, bien qu’intéressante, posait un problème : tant que nous n’avions pas trouvé de spécialiste, nous ne pouvions commencer la rédaction de notre TPE. Ainsi, plus le temps passait et plus j’angoissais à l’idée qu’il faudrait bientôt faire le TPE dans l’urgence. Bien que ma découverte fortuite du Centre Anti-Poison me permît de reprendre confiance, il fallut plusieurs semaines pour enfin trouver des données concrètes. Seuls trois mois nous séparaient alors de la remise des TPE. C’était donc bien dans l’urgence que nous avions à rédiger notre TPE, et chaque jour je m’inquiétais à l’idée que nous ne rendrions pas notre TPE à temps. Finalement, nous réussîmes à finir notre TPE à temps, ceci me débarrassant d’un travail qui s’ajoutait aux nombreux autres devoirs que je devais finir pour la même semaine.
Bien que je me sois un peu désintéressé du sujet en début d’année, l’angoisse permanente me rappela rapidement au travail, et je donnais donc le meilleur de moi-même pour rendre ce TPE le plus intéressant, le plus captivant possible, pendant les derniers mois qu’il nous restait.
Ainsi je puis dire que l’expérience du TPE, ce cheminement long et parfois pénible, cet « exposé géant », fut enrichissant pour moi. C’est ainsi avec un certain regret, mais aussi un soulagement, que j’apprends que le TPE est supprimé en terminale. Bien que je n’aurai pas à m’investir de la sorte l’année prochaine, ceci me débarrassant d’un long et difficile travail, je ne pourrai donc pas, connaissant maintenant bien la démarche du TPE, produire un travail que j’aurai pu étayer par mon expérience.
Sur ce, j’espère que vous aurez un certain plaisir à découvrir ce TPE et ces quelques lignes (car quoi de plus ennuyeux et énervant que de lire quelque chose d’inintéressant).
Matteo CARREGA :
Ce TPE a été une belle, longue et épineuse aventure. Au début de l’année je me suis questionné sur son utilité. Je n’arrivais pas à comprendre à quoi cela pouvait servir. Mais maintenant, avec du recul, je peux trouver une réponse à mes questions. Je l’ai perçu comme une production commune mettant en œuvre les qualités de chacun, et nous préparant à des épreuves orales telles que le bac.
Le travail collectif a permis de souder des amitiés et de créer un esprit de groupe. Presque tout le monde a rempli sa tâche, même si parfois des disputes ont éclaté. Des mésententes ont eu lieu, mais tout ceci a été constructif pour avancer sans hypocrisie et dans de bonnes conditions. Chacun a apporté sa touche à cette peinture ici scientifique. Chacun a mis en valeur ses capacités, ce qui fait le charme de l’esprit de groupe. Pour ma part j’ai pris un grand plaisir à réaliser les vidéos, étant passionné de cinéma et voulant en faire un projet professionnel. Ceci à créé une motivation en moi, m'a immergé dans le sujet.
Nous sommes tombés sur ce sujet grâce à un concours de circonstances. Tout d’abord, nous étions lancés sur la voie suite au mélange du Schweppes et du Bailey’s qui se solidifie. Nous étions fascinés par cette expérience. La dangerosité de cette réaction, si elle venait à s’effectuer dans l’estomac d’un être humain, nous a ouvert la porte sur le sujet actuel : les mélanges dangereux à partir de produits du quotidien.
Nous avons tout d’abord eu un peu de mal à démarrer et à trouver des informations. Toutes nos recherches n’aboutissaient à rien de vraiment concret. Puis comme touchés par la grâce,nous sommes tombés sur une fort sympathique personne au centre anti-poison de l’hôpital Fernand Widal. Celle-ci nous a gentiment aidés pour la recherche documentaire. Grâce à ces documents recueillis, nous avons pu apporter de la matière à notre TPE et démarrer réellement le travail. Malgré d’autres problèmes qui nous ont barrés la route, tels que l’interview ou l’expérience, nous avons su faire avec, nous adapter aux circonstances. Nous avons essayé de construire un TPE avec du sérieux, de la rigueur, en essayant de le pimenter d’originalité. En se mettant dans votre peau, correcteur, nous avons constaté que si quelques idées sortaient du classique, ceci nous et vous ferait plaisir. Tout au long de l’année, il y a eu une remise en question de soi même : « Est-ce un bon sujet ? Mais alors quoi d’autre ? Non c’est un bon sujet. Mais en es-tu sûr ? Va-t-on le rendre à temps ? Avons-nous assez d’informations ? Doit-on plus creuser ? » Avec l’aide des professeurs, nous avons pu canaliser nos efforts.
Parfois au cour des mois, le TPE s’est transformé en poids insupportable. Avec tout le travail à fournir en cours, le temps pour le développer était restreint. Malgré tout, nous avons aussi un peu traîné et perdu ainsi du temps inutilement. Je ne voulais pas vraiment affronter le TPE en face en me disant : « On a le temps ». Mais une fois que le temps nous a rattrapé, que le sablier a rendu son dernier grain de sable, alors il n’y avait plus de doutes, que des certitudes, il fallait finir ce TPE et vite. Tout d’un coup, tout s’est accéléré. C’est ainsi que nous l’avons terminé sur le fil. Bizarrement, je n’ai jamais été vraiment anxieux, j’étais serein et persuadé que nous le finirions à temps même si mon inconscient était nerveux. Lorsque le dernier mot est venu se placer dans la dernière phrase, lorsqu’il fut fini une fois pour toutes, alors j’en étais fier. J’ai sué mais j’y suis arrivé, me suis-je dit, et c’est ce moment qui se goûte avec délice.
Voici quelques impressions que j’ai ressenties en espérant ne pas vous avoir ennuyé, lecteur et correcteur.
Balthazar ABECASSIS :
J’ai tout d’abord ressenti une grande excitation à l’idée de faire notre travail sur les mélanges dangereux des produits du quotidien : je m’imaginais surement en train de fabriquer des bombes artisanales avec du savon (dans le rôle de Brad Pitt dans « Fight club »). Mais je me suis vite rendu compte que notre travail ne consisterait pas, heureusement, à découvrir les subtilités des explosifs ménagers.
Contrairement à ce que nous pensions au début de l’année, les informations sur ce sujets sont rares et plus encore les personnes qui se spécialisent dans cette branche. Nous avons eu du mal à trouver des renseignements, ce qui m’a découragé et m’a poussé à me désintéresser du sujet. De plus, nos professeurs nous ont interdit d’expérimenter les mélanges dangereux que nous avions extraits de nos maigres quantités de documents. Imaginez-vous alors dans quel découragement je me suis trouvé : Nous n’avions rien, notre TPE se résumait peu ou prou à une seule chose : son titre.
Mais là, je dois féliciter mes camarades Ariel, Félix et Matteo qui n'ont pas baissé les bras et trouvé quelques moyens pour passer outre les difficultés (reconstitutions, docu-fiction, humour...)
Mais finalement, à force d’efforts, nous avons réussi à trouver quelques idées, qui, j’espère, ne vous déplairont pas. Gâace à la bonne volonté de l’équipe entière, nous avons remédié aux problèmes majeurs de notre TPE.
Dans un premier temps, je fus très vite emballé par l’idée d’un TPE. Déjà l’année dernière, j’étais enthousiaste à l’idée de ce travail collectif. Tout d’abord, lors de la recherche d’un sujet, l’idée m’est venue d’utiliser ce qui m’avait été présenté comme une légende urbaine : le mélange Bailey’s et Schweppes, le mélange des deux breuvages produit un ciment très solide en quelques secondes. C’est lors des premières recherches autour du mélange des deux boissons que les complications débutèrent et que nous fûmes tous calmés dans nos ardeurs de chercheurs en herbe.
Nous décidâmes alors de nous généraliser. L’idée de mélange dangereux ou avec une expérience impressionnante à réaliser nous plaisant, nous nous sommes donc dirigés vers les mélanges de produits ménagers dangereux.
Mais lesquels choisir ? Nous avons donc décidé de laisser un spécialiste nous guider, c’est là que le concept de démarche naquit : un spécialiste nous indiquerait quelques mélanges, soit les plus dangereux, soit les plus fréquents ; nous en réaliserions les expériences puis les étudieraient. Mais c’est là où ce sont enchaînées les grosses complications. Nous avons été confrontés à un grand nombre de personnes désagréables qui ne voulaient pas nous aider par simple solidarité, ou bien étaient bloquées par la confidentialité (les données brutes des hôpitaux). Exceptée la documentaliste du Centre Anti-Poison de Paris qui nous a été d’une grande aide ; sans sa disponibilité, nous serions restés bloqués encore longtemps ou aurions changé de sujet.
Mattéo eut donc la merveilleuse idée du documentaire-fiction qui nous permettait d’intégrer toutes les documentations que nous pourrions obtenir pour nous faire diriger fictivement vers les mélanges qui nous arrangeaient le plus.
Nous prîmes une voie alternative. Par le biais de ce blog, nous avons pu intégrer notre touche personnelle aux recherches. C’est là un aspect que j’ai tout particulièrement apprécié dans cette démarche. Nous avons combiné nos talents : Mattéo à la caméra, Félix pour l’aspect compréhension du jargon de physique et moi-même autour de l’aspect technique (le blog) et dans l’organisation de la construction du travail, et nous tous quant aux recherches et à la rédaction des articles.
Pour ce qui est de l’aspect travail, étant habitué aux exposés et diverses présentations classiques, je ne m’attendais pas à la nécessité d’un tel approfondissement et à la somme de travail conséquente.
Ce devoir m’aura éclairci quant à la somme et le type de travail à fournir après le baccalauréat, c’est un travail où l’abstrait est banni, la spécialisation est de plus en plus précise et la connaissance plus dirigée, mais beaucoup plus poussée.
Ce fut un plaisir de réaliser ce TPE. Je me serais révélé un esprit collectif prononcé et, surtout, me serais épanoui lors de ce travail bien concret dans un cycle où les programmes conçus sont abstraits.
Félix CHEYSSON :
Au début de l’année, lorsqu’on m’annonçait qu’on devrait faire un TPE, je me suis questionné sur ce travail, bien que mon grand frère m’en avait déjà parlé. Le TPE était une nouveauté pour moi : je n’avais encore jamais effectué un travail très approfondi sur un domaine particulier. Ainsi, en compagnie de bons amis, nous avons cherché un sujet.
L’idée nous est d’abord venue avec le mélange Schweppes-Bailey’s, « boisson » qui se solidifie lors de la mise en contact des deux produits. Nous pensions que l’ingestion accidentelle (ou volontaire) de ce cocktail pouvait entraîner la solidification du mélange dans l’estomac, et donc la mort, si ingestion de trop grande quantité. Ainsi nous est venue l’idée de notre TPE : mélanges de produits anodins pouvant entraîner de graves accidents.
Nous décidâmes alors d’une démarche : trouver un spécialiste des accidents fréquents survenant à la suite d’un mélange de deux produits du quotidien, faire une interview filmée, et tirer de cet entretien le ou les mélanges compatibles à notre TPE que nous pourrions exploiter. Nous fîmes donc de nombreuses recherches, afin de trouver l’homme qui nous éclairerait. Mais elles furent infructueuses : aucun hôpital ne voulait nous accorder une entrevue. Heureusement, la découverte du Centre Anti-Poison nous redonna espoir, bien que l’entretien avec un spécialiste ne soit pas envisageable.
Nous nous lançâmes donc dans une série de recherches, afin de trouver le mélange à étudier. Un produit attira particulièrement notre attention : l’eau de Javel. De nombreux accidents étaient survenus à cause de mélanges dans lequel ce produit intervenait. C’est donc à partir de ce produit que nous construisîmes notre TPE, dont voilà le résultat un peu plus haut.
Cette démarche, bien qu’intéressante, posait un problème : tant que nous n’avions pas trouvé de spécialiste, nous ne pouvions commencer la rédaction de notre TPE. Ainsi, plus le temps passait et plus j’angoissais à l’idée qu’il faudrait bientôt faire le TPE dans l’urgence. Bien que ma découverte fortuite du Centre Anti-Poison me permît de reprendre confiance, il fallut plusieurs semaines pour enfin trouver des données concrètes. Seuls trois mois nous séparaient alors de la remise des TPE. C’était donc bien dans l’urgence que nous avions à rédiger notre TPE, et chaque jour je m’inquiétais à l’idée que nous ne rendrions pas notre TPE à temps. Finalement, nous réussîmes à finir notre TPE à temps, ceci me débarrassant d’un travail qui s’ajoutait aux nombreux autres devoirs que je devais finir pour la même semaine.
Bien que je me sois un peu désintéressé du sujet en début d’année, l’angoisse permanente me rappela rapidement au travail, et je donnais donc le meilleur de moi-même pour rendre ce TPE le plus intéressant, le plus captivant possible, pendant les derniers mois qu’il nous restait.
Ainsi je puis dire que l’expérience du TPE, ce cheminement long et parfois pénible, cet « exposé géant », fut enrichissant pour moi. C’est ainsi avec un certain regret, mais aussi un soulagement, que j’apprends que le TPE est supprimé en terminale. Bien que je n’aurai pas à m’investir de la sorte l’année prochaine, ceci me débarrassant d’un long et difficile travail, je ne pourrai donc pas, connaissant maintenant bien la démarche du TPE, produire un travail que j’aurai pu étayer par mon expérience.
Sur ce, j’espère que vous aurez un certain plaisir à découvrir ce TPE et ces quelques lignes (car quoi de plus ennuyeux et énervant que de lire quelque chose d’inintéressant).
Matteo CARREGA :
Ce TPE a été une belle, longue et épineuse aventure. Au début de l’année je me suis questionné sur son utilité. Je n’arrivais pas à comprendre à quoi cela pouvait servir. Mais maintenant, avec du recul, je peux trouver une réponse à mes questions. Je l’ai perçu comme une production commune mettant en œuvre les qualités de chacun, et nous préparant à des épreuves orales telles que le bac.
Le travail collectif a permis de souder des amitiés et de créer un esprit de groupe. Presque tout le monde a rempli sa tâche, même si parfois des disputes ont éclaté. Des mésententes ont eu lieu, mais tout ceci a été constructif pour avancer sans hypocrisie et dans de bonnes conditions. Chacun a apporté sa touche à cette peinture ici scientifique. Chacun a mis en valeur ses capacités, ce qui fait le charme de l’esprit de groupe. Pour ma part j’ai pris un grand plaisir à réaliser les vidéos, étant passionné de cinéma et voulant en faire un projet professionnel. Ceci à créé une motivation en moi, m'a immergé dans le sujet.
Nous sommes tombés sur ce sujet grâce à un concours de circonstances. Tout d’abord, nous étions lancés sur la voie suite au mélange du Schweppes et du Bailey’s qui se solidifie. Nous étions fascinés par cette expérience. La dangerosité de cette réaction, si elle venait à s’effectuer dans l’estomac d’un être humain, nous a ouvert la porte sur le sujet actuel : les mélanges dangereux à partir de produits du quotidien.
Nous avons tout d’abord eu un peu de mal à démarrer et à trouver des informations. Toutes nos recherches n’aboutissaient à rien de vraiment concret. Puis comme touchés par la grâce,nous sommes tombés sur une fort sympathique personne au centre anti-poison de l’hôpital Fernand Widal. Celle-ci nous a gentiment aidés pour la recherche documentaire. Grâce à ces documents recueillis, nous avons pu apporter de la matière à notre TPE et démarrer réellement le travail. Malgré d’autres problèmes qui nous ont barrés la route, tels que l’interview ou l’expérience, nous avons su faire avec, nous adapter aux circonstances. Nous avons essayé de construire un TPE avec du sérieux, de la rigueur, en essayant de le pimenter d’originalité. En se mettant dans votre peau, correcteur, nous avons constaté que si quelques idées sortaient du classique, ceci nous et vous ferait plaisir. Tout au long de l’année, il y a eu une remise en question de soi même : « Est-ce un bon sujet ? Mais alors quoi d’autre ? Non c’est un bon sujet. Mais en es-tu sûr ? Va-t-on le rendre à temps ? Avons-nous assez d’informations ? Doit-on plus creuser ? » Avec l’aide des professeurs, nous avons pu canaliser nos efforts.
Parfois au cour des mois, le TPE s’est transformé en poids insupportable. Avec tout le travail à fournir en cours, le temps pour le développer était restreint. Malgré tout, nous avons aussi un peu traîné et perdu ainsi du temps inutilement. Je ne voulais pas vraiment affronter le TPE en face en me disant : « On a le temps ». Mais une fois que le temps nous a rattrapé, que le sablier a rendu son dernier grain de sable, alors il n’y avait plus de doutes, que des certitudes, il fallait finir ce TPE et vite. Tout d’un coup, tout s’est accéléré. C’est ainsi que nous l’avons terminé sur le fil. Bizarrement, je n’ai jamais été vraiment anxieux, j’étais serein et persuadé que nous le finirions à temps même si mon inconscient était nerveux. Lorsque le dernier mot est venu se placer dans la dernière phrase, lorsqu’il fut fini une fois pour toutes, alors j’en étais fier. J’ai sué mais j’y suis arrivé, me suis-je dit, et c’est ce moment qui se goûte avec délice.
Voici quelques impressions que j’ai ressenties en espérant ne pas vous avoir ennuyé, lecteur et correcteur.
Balthazar ABECASSIS :
J’ai tout d’abord ressenti une grande excitation à l’idée de faire notre travail sur les mélanges dangereux des produits du quotidien : je m’imaginais surement en train de fabriquer des bombes artisanales avec du savon (dans le rôle de Brad Pitt dans « Fight club »). Mais je me suis vite rendu compte que notre travail ne consisterait pas, heureusement, à découvrir les subtilités des explosifs ménagers.
Contrairement à ce que nous pensions au début de l’année, les informations sur ce sujets sont rares et plus encore les personnes qui se spécialisent dans cette branche. Nous avons eu du mal à trouver des renseignements, ce qui m’a découragé et m’a poussé à me désintéresser du sujet. De plus, nos professeurs nous ont interdit d’expérimenter les mélanges dangereux que nous avions extraits de nos maigres quantités de documents. Imaginez-vous alors dans quel découragement je me suis trouvé : Nous n’avions rien, notre TPE se résumait peu ou prou à une seule chose : son titre.
Mais là, je dois féliciter mes camarades Ariel, Félix et Matteo qui n'ont pas baissé les bras et trouvé quelques moyens pour passer outre les difficultés (reconstitutions, docu-fiction, humour...)
Mais finalement, à force d’efforts, nous avons réussi à trouver quelques idées, qui, j’espère, ne vous déplairont pas. Gâace à la bonne volonté de l’équipe entière, nous avons remédié aux problèmes majeurs de notre TPE.
Inscription à :
Articles (Atom)